open wikipedia design.
Пероксид водню (перекис водню), H 2 O 2 - найпростіший представник пероксидов . Безбарвна рідина з «Металевим» смаком , Необмежено розчинна в воді , спирті і ефірі . Концентровані водні розчини вибухонебезпечні. Пероксид водню є хорошим розчинником. З води виділяється у вигляді нестійкого кристаллогидрата H2O2 ∙ 2H2O.
Молекула пероксиду водню має наступну будову: 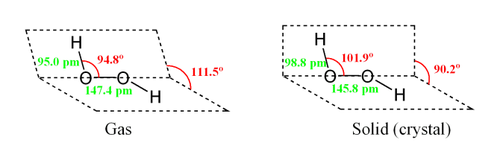
Внаслідок несиметричності молекула H2O2 сильно полярна (Μ = 0,7⋅10-29 Кл · м). відносно висока в'язкість рідкого пероксиду водню обумовлена розвиненою системою водневих зв'язків . оскільки атоми кисню мають неподілені електронні пари , Молекула H2O2 також здатна утворювати донорно-акцепторні зв'язки .
Обидва атома кисню знаходяться в проміжній ступеня окислення -1, що і обумовлює здатність пероксидів виступати в ролі як окислювачів, так і відновників. Найбільш характерні для них окисні властивості:
N a 2 SO 3 + H 2 O 2 → N a 2 SO 4 + H 2 O {\ displaystyle {\ mathsf {Na_ {2} SO_ {3} + H_ {2} O_ {2} \ rightarrow Na_ {2} SO_ {4} + H_ {2} O}}} M n (OH) 2 + H 2 O 2 → M n O (OH) 2 + H 2 O {\ displaystyle {\ mathsf {Mn (OH) _ {2} + H_ {2} O_ {2} \ rightarrow MnO (OH) _ {2} + H_ {2} O}}}
При взаємодії з сильними окислювачами пероксид водню виступає в ролі відновника, окислюючись до атомарного кисню:
2 A g NO 3 + H 2 O 2 → 2 A g + 2 O + 2 HNO 3 {\ displaystyle {\ mathsf {2AgNO_ {3} + H_ {2} O_ {2} \ rightarrow 2Ag + 2O + 2HNO_ {3 }}}}
Молекула пероксиду водню сильно полярна, що призводить до виникнення водневих зв'язків між молекулами. Зв'язок O-O міцна, тому H2O2 - нестійке з'єднання, легко розкладається. Також цьому може посприяти присутність іонів перехідних металів . У розведених розчинах пероксид водню теж нестійкий і мимовільно диспропорционирует на H2O і O2. Реакція диспропорціонування каталізується іонами перехідних металів, деякими білками:
2 H 2 O 2 → 2 H 2 O + O 2 {\ displaystyle {\ mathsf {2H_ {2} O_ {2} \ rightarrow 2H_ {2} O + O_ {2}}}}
Однак дуже чистий пероксид водню досить стійкий.
Пероксид водню проявляє слабкі кислотні властивості (К = 1,4⋅10-12), і тому дисоціює за двома ступенями:
H 2 O 2 ⇄ H + + H O 2 -; HO 2 - ⇄ H + + O 2 2 - {\ displaystyle {\ mathsf {H_ {2} O_ {2} \ rightleftarrows H ^ {+} + HO_ {2} ^ {-}; ~~~~~~ HO_ {2} ^ {-} \ rightleftarrows H ^ {+} + O_ {2} ^ {2}}}}
При дії концентрованого розчину Н2O2 на деякі гідроксиди в ряді випадків можна виділити пероксиди металів, які можна розглядати як солі пероксиду водню ( Li2O2 , MgO2 та ін.):
H 2 O 2 + 2 N a OH → N a 2 O 2 + 2 H 2 O {\ displaystyle {\ mathsf {H_ {2} O_ {2} + 2NaOH \ rightarrow Na_ {2} O_ {2} + 2H_ { 2} O}}} H 2 O 2 + B a (OH) 2 → B a O 2 ↓ + 2 H 2 O {\ displaystyle {\ mathsf {H_ {2} O_ {2} + Ba (OH) _ {2} \ rightarrow BaO_ { 2} \ downarrow + 2H_ {2} O}}}
Пероксид водню може проявляти як окисні, так і відновні властивості. Наприклад, при взаємодії з оксидом срібла він є відновником:
H 2 O - 1 2 + A g 2 O ⟶ 2 A g + O 0 2 + H 2 O {\ displaystyle {\ mathsf {H_ {2} {\ stackrel {-1} {O}} _ {2} + Ag_ {2} O \ longrightarrow 2Ag + {\ stackrel {0} {O}} _ {2} + H_ {2} O}}}
В реакції з нітритом калію з'єднання служить окислювачем:
KNO 2 + H 2 O - 1 | 2 ⟶ KNO - 2 3+ H 2 O {\ displaystyle {\ mathsf {KNO_ {2} + H_ {2} {\ stackrel {-1} {O}} _ {2} \ longrightarrow KN {\ stackrel {-2} {O}} _ {3} + H_ {2} O}}}
Пероксидна група [-O-O-] входить до складу багатьох речовин. Такі речовини називають пероксидамі, або пероксидними сполуками. До них відносяться пероксиди металів ( Na2O2 , BaO2 та ін.). Кислоти, що містять пероксидную групу, називають пероксокислот , Наприклад, пероксомонофосфорная H3PO5, пероксодісерная H2S2O8 і пероксоазотная HNO4 кислоти.
Окислювально-відновні властивості [ правити | правити код ]
Пероксид водню має окисними , а також відновними властивостями. він окисляє нітрити в нітрати , виділяє йод з иодидов металів, розщеплює ненасичені сполуки за місцем подвійних зв'язків . Пероксид водню відновлює солі золота і срібла , а також марганець при реакції з водним розчином перманганату калію в кислому середовищі.
При відновленні Н2O2 утворюється Н2О або ОН, наприклад:
H 2 O 2 + 2 KI + H 2 SO 4 → I 2 + K 2 SO 4 + 2 H 2 O {\ displaystyle {\ mathsf {H_ {2} O_ {2} + 2KI + H_ {2} SO_ {4 } \ rightarrow I_ {2} + K_ {2} SO_ {4} + 2H_ {2} O}}}
При дії сильних окислювачів H2O2 проявляє відновні властивості, виділяючи вільний кисень:
O 2 2 - → O 2 + 2 e - {\ displaystyle {\ mathsf {O_ {2} ^ {2 -} \ rightarrow O_ {2} + 2 e ^ {-}}}}
наприклад:
3 H 2 O 2 + 2 KM n O 4 → 2 M n O 2 + 2 KOH + 3 O 2 ↑ + 2 H 2 O {\ displaystyle {\ mathsf {3H_ {2} O_ {2} + 2KMnO_ {4} \ rightarrow 2MnO_ {2} + 2KOH + 3O_ {2} \ uparrow + 2H_ {2} O}}}
реакцію KMnO4 з Н2O2 використовують в хімічному аналізі для визначення змісту Н2O2:
5 H 2 O 2 + 2 KM n O 4 + 3 H 2 SO 4 → 5 O 2 + 2 M n SO 4 + K 2 SO 4 + 8 H 2 O {\ displaystyle {\ mathsf {5H_ {2} O_ { 2} + 2KMnO_ {4} + 3H_ {2} SO_ {4} \ rightarrow 5O_ {2} + 2MnSO_ {4} + K_ {2} SO_ {4} + 8H_ {2} O}}}
Окислення органічних сполук пероксидом водню (наприклад, сульфідів і тиолов ) Доцільно проводити в середовищі оцтової кислоти .
Пероксид водню відноситься до реактивним формам кисню і при підвищеному утворенні в клітці викликає оксидативний стрес . деякі ферменти , наприклад глюкозоксидаза , Утворюють в ході окислювально-відновної реакції пероксид водню, який може відігравати захисну роль в якості бактерицидного агента. У клітинах ссавців немає ферментів, які б відновлювали кисень до перекису водню. Однак кілька ферментних систем ( ксантиноксидаза , НАДФ • H-оксидаза , циклооксигеназа та ін.) продукують супероксид , Який спонтанно або під дією супероксиддисмутази перетворюється в пероксид водню.
Історично першим промисловим методом синтезу пероксиду водню був електроліз сірчаної кислоти або розчину сульфату амонію в сірчаної кислоти, в ході якого утворюється пероксодісерная кислота , З подальшим гідролізом останньої до пероксиду і сірчаної кислоти:
H 2 S 2 O 8 + 2 H 2 O → H 2 O 2 + 2 H 2 SO 4 {\ displaystyle {\ mathsf {H_ {2} S_ {2} O_ {8} + 2H_ {2} O \ rightarrow H_ {2} O_ {2} + 2H_ {2} SO_ {4}}}}
З середини XX століття персульфатний процес синтезу пероксиду водню був витіснений антрахінонових процесом, розробленим компанією BASF в 1930-х [2] . У цьому процесі формально йде окислення водню киснем повітря з катализом алкілпроізводнимі антрахинона :
Контроль здійснюється шляхом автоокисления алкілантрагідрохінонов (зазвичай 2-етил, 2-трет-бутил-і 2-пентілантрагідрохінонов) киснем повітря з утворенням антрахинонов і пероксиду водню. Реакція проводиться в розчині алкілантрагідрохінонов в бензолі з додаванням вторинних спиртів, по завершенні процесу пероксид водню екстрагують з органічної фази водою. Для регенерації вихідних антрагідрохінонов бензоловий розчин антрахинонов відновлюють воднем в присутності каталітичних кількостей паладію [3] .
Пероксид водню також може бути отриманий каталітичним окисленням ізопропілового спирту [4] :
(CH 3) 2 CHOH + O 2 → (CH 3) 2 CO + H 2 O 2 {\ displaystyle {\ mathsf {(CH_ {3}) _ {2} CHOH + O_ {2} \ rightarrow (CH_ {3 }) _ {2} CO + H_ {2} O_ {2}}}} ,
при цьому цінним побічним продуктом цієї реакції є ацетон , Проте в широких масштабах в промисловості цей метод в даний час не використовується.
У лабораторних умовах для одержання пероксиду водню використовують реакцію:
B a O 2 + H 2 SO 4 → B a SO 4 ↓ + H 2 O 2 {\ displaystyle {\ mathsf {BaO_ {2} + H_ {2} SO_ {4} \ rightarrow BaSO_ {4} \ downarrow + H_ {2} O_ {2}}}}
Концентрування і очищення пероксиду водню проводять обережною перегонкою .
Останнім часом (кін. XX ст.) Вдалося синтезувати H2O3 і H2O4. Ці сполуки дуже нестійкі. При звичайних температурах ( н.у. ) Вони розкладаються за частки секунди, однак при низьких температурах порядку -70 ° C існують годинами. спектро -Хімічні дослідження показує, що їх молекули мають зигзагоподібну ланцюгову структуру (подібну сульфаніл ): H-O-O-O-H, H-O-O-O-O-H. [5]
Завдяки своїм сильним окислювальним властивостям пероксид водню знайшов широке застосування в побуті і в промисловості, де використовується, наприклад, як відбілювач на текстильному виробництві і при виготовленні паперу. застосовується як ракетне паливо , Як окислювач або як однокомпонентне (з розкладанням на каталізаторі), в тому числі для приводу турбонасосних агрегатів . [6] Використовується у аналітичної хімії , В якості піноутворювача при виробництві пористих матеріалів, у виробництві дезінфікуючих і відбілюючих засобів. У промисловості пероксид водню також знаходить своє застосування в якості каталізатора, гидрируются агента, як епоксідірующій агент при епоксідірованія олефінів.
Хоча розбавлені розчини перекису водню застосовуються для невеликих поверхневих ран, дослідження показали, що цей метод, забезпечуючи антисептичний ефект і очищення, також продовжує час загоєння. [7] [8] Володіючи хорошими очисними властивостями, пероксид водню насправді не прискорює загоєння ран. Досить високі концентрації, що забезпечують антисептичний ефект, можуть також продовжувати час загоєння через пошкодження прилеглих до рани клітин. [9] Більш того, пероксид водню може заважати загоєнню і сприяти утворенню рубців через руйнування новообразующимися клітин шкіри. [10] Однак в якості засобу для очищення глибоких ран складного профілю, гнійних затекло , флегмон і інших гнійних ран, санація яких утруднена, пероксид водню залишається кращим препаратом, так як він володіє не тільки антисептичним ефектом, але і створює велику кількість піни при взаємодії з ферментом каталазой . Це в свою чергу дозволяє розм'якшити і відокремити від тканин некротизовані ділянки, згустки крові, гною, які будуть легко змиті подальшим введенням в порожнину рани антисептичної розчину. Без попередньої обробки пероксидом водню антисептичний розчин не зможе видалити ці патологічні утворення, що призведе до значного збільшення часу загоєння рани і погіршить стан хворого.
Перекис водню застосовують для розчинення пробок в слухових каналах . Розчин вступає в реакцію з вушної сірої і розчиняє пробку.
Пероксид водню застосовується також для знебарвлення волосся [11] і відбілювання зубів [12] , Однак ефект в обох випадках заснований на окисленні, а отже - руйнуванні тканин. Під час відбілювання зубів, однак, не відбувається руйнування тканин. Пігментовані білки дентину починають розкручуватися до первинної структури (як якщо б білок яйця з вареного став більш сирим), при цьому зв'язку не руйнуються, тобто цей процес звернемо. Емаль сама по собі прозора, і ефект відбілювання досягається за рахунок різниці в відображенні світла дентином.
В харчової промисловості розчини пероксиду водню застосовуються для дезінфекції технологічних поверхонь обладнання, які безпосередньо прилягають до продукцією. Крім того, на підприємствах з виробництва молочної продукції та соків, розчини перекису водню використовуються для дезінфекції упаковки (технологія « Тетра Пак »). Для технічних цілей пероксид водню застосовують у виробництві електронної техніки.
У побуті застосовується також для виведення плям MnO2, що утворилися при взаємодії перманганату калію ( «марганцівки») з предметами (з огляду на його відновлювальних властивостей).
3% -ний розчин пероксиду водню використовується в акваріумістики для пожвавлення задихнувшись риби, а також для очищення акваріумів та боротьби з небажаною флорою і фауною в акваріумі [13] .
З 90-х років ХХ століття 3% -ний розчин пероксиду водню просувався цілителем І. П. Неумивакіна для прийому всередину як універсальний засіб лікування і оздоровлення людини. Наукового підтвердження допустимості та ефективності даний метод не має.
Перекис водню використовується в відомому досвіді , Що демонструє багатократне збільшення обсягу речовини в результаті хімічної реакції [14] .
Випускається у вигляді водних розчинів, стандартна концентрація 1-6%, 30, 38, 50, 60, 85, 90 і 98% . 30% водний розчин пероксиду водню, стабілізований додаванням фосфатів натрію, називається пергідролем. Що випускається у вигляді таблеток твердого клатрата з сечовиною пероксид водню називається гідропериту .
Незважаючи на те, що пероксид водню нетоксичний , Його концентровані розчини при попаданні на шкіру, слизові оболонки і в дихальні шляхи викликають опіки. У великих концентраціях недостатньо чистий пероксид водню може бути вибухонебезпечний. Небезпечний при прийомі всередину концентрованих розчинів. Викликає виражені деструктивні зміни, подібні з діями лугів. Летальна доза 30% -го розчину пероксиду водню (пергідролю) - 50-100 мл [15] .
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0335.html
- ↑ H. Riedl and G. Pfleiderer, US Patent 2,158,525 (2 October 1936 in USA, and 10 October 1935 in Germany) to IG Farbenindustrie, Germany
- ↑ Jose M. Campos-Martin, Gema Blanco-Brieva, Jose LG Fierro; Blanco-Brieva; Fierro. Hydrogen Peroxide Synthesis: An Outlook beyond the Anthraquinone Process (англ.) // Angewandte Chemie International Edition : Journal. - 2006. - Vol. 45, no. 42. - P. 6962-6984. - DOI : 10.1002 / anie.200503779 . - PMID 17039551 .
- ↑ Burgess, AR; Cullis, CF; Newitt, EJ 365. The gaseous oxidation of isopropyl alcohol. Part 1. The influence of temperature, pressure, and mixture composition on the formation of hydrogen peroxide and other products (Англ.) // Journal of the Chemical Society (Англ.): Journal. - Chemical Society , 1961. - 1 January (no. 0). - P. 1884-1893. - ISSN 0368-1769 . - DOI : 10.1039 / JR9610001884 .
- ↑ Ахметов Н. С. Загальна і неорганічна хімія. - 2-е вид. - М.: Вища школа, 1988. - с. 304.
- ↑ Космонавтика, енциклопедія. М., 1985.
- ↑ O'Connor, Anahd. Really? The Claim: Hydrogen Peroxide Is a Good Treatment for Small Wounds , New York Times (19 червня 2007). Дата обігу 13 липня 2011 року.
- ↑ Carroll, Aaron E., Rachel C. Vreeman. Medical myths do not die easily , CNN (12 липня 2011). Дата обігу 13 липня 2011 року.
- ↑ Joseph M. Ascenzi, Handbook of Disinfectant and Antiseptics, CRC Press, 1996, ISBN 0824795245 , Page 161.
- ↑ Wilgus TA, Bergdall VK, Dipietro LA, Oberyszyn TM Hydrogen peroxide disrupts scarless fetal wound repair (Неопр.) // Wound Repair Regen. - 2005. - Т. 13, № 5. - С. 513-519. - DOI : 10.1111 / j.1067-1927.2005.00072.x . - PMID 16176460 .
- ↑ Засоби для освітлення волосся
- ↑ Способи відбілювання зубів
- ↑ М. Бейлі, П. Бергресс. Золота книга акваріума. Повний довідник по догляду за прісноводними тропічними рибами. - М.: Аквариум ЛТД, 2004.
- ↑ Elephant's Toothpaste (неопр.). University of Utah Chemistry Demonstrations. University of Utah. Дата звернення 21 березня 2014.
- ↑ Протипоказання до застосування перекису водню в лікувальних цілях архівна копія від 25 серпня 2011 року на Wayback Machine [ неавторитетний джерело? ]
- Ахметов Н. С. Загальна та неорганічна хімія. - М.: Вища школа, 2001..
- Карапетьянц М. Х. , Дракин С. І. Загальна та неорганічна хімія. - М.: Хімія, 1994.



